Nowe procesy technologiczne, w tym produkcja bioetanolu II generacji, różnią się od tych spotykanych w klasycznych procesach fermentacyjnych, a więc wymagają innych, bardzo konkretnych wyzwań.
Drożdże należą do najlepiej zbadanych drobnoustrojów występujących w środowiskach naturalnych. Dotąd zostało opisanych ponad 1500 gatunków tych drobnoustrojów (Boekhout, 2005). Wiele z nich znalazło zastosowanie w różnych procesach fermentacyjnych (Sicard i Legras, 2011). Taksonomiczna analiza mikroflory aktywnej w spontanicznych procesach fermentacyjnych ujawniła ogromną różnorodność drożdży, choć dominującym gatunkiem jest nadal Saccharomyces cerevisiae (Bokulich i in., 2014; Steensels i Verstrepen, 2014). Gatunek ten stał się organizmem modelowym w badaniach naukowych, zapewniając postęp w badaniach i otrzymanie wartościowych wyników dla różnych komórek eukariotycznych (Botstein, Chervitz i Cherry, 1997). S. cerevisiae był także pierwszym gatunkiem, którego cały genom poddano sekwencjonowaniu (Goffeau i in., 1996). Zdolność S. cerevisiae do metabolizmu zarówno w warunkach tlenowych jak i beztlenowych oraz produkcja etanolu spowodowały, że gatunek ten jest stosowany od wielu lat w postaci kultur starterowych do produkcji pieczywa oraz napojów fermentowanych (Querol, 2003).
Jednak nowe procesy technologiczne, w tym produkcja bioetanolu II generacji, różnią się od tych spotykanych w klasycznych procesach fermentacyjnych, a więc wymagają innych, bardzo konkretnych wyzwań. Obejmują one m.in. środowiska fermentacyjne o różnym składzie źródeł węgla i energii, a także o znacznej zawartości różnych cytotoksycznych związków hamujących wzrost mikroorganizmów przemysłowych (Basso, Basso i Rocha, 2011; Taylor i in., 2012).
Silna presja, by poprawić opłacalność ekonomiczną wytwarzania bioetanolu z odpadowych materiałów roślinnych sprawia, że drożdże S. cerevisiae stają się nieefektywne w procesach fermentacji hydrolizatów lignocelulozowych. Fakt ten stymuluje badania nad zastosowaniem innych, niekonwencjonalnych gatunków drożdży, o szerokim spektrum asymilowanych źródeł węgla, opornych za związki cytotoksyczne.
Etanol II generacji
Produkcję etanolu na skalę przemysłową prowadzi się w sposób konwencjonalny stosując mezofilne szczepy drożdży  Saccharomyces sp. Źródło węgla stanowi wtedy melasa, cukier, sok z trzciny cukrowej oraz z buraka cukrowego, skrobia kukurydziana lub ziemniaczana. Są to jednak surowce drogie, a ich dostępność zawsze zależy od sezonowej produktywności. Ponadto zastosowanie spożywczej kukurydzy czy ziemniaków w produkcji biopaliw jest kwestią kontrowersyjną. Dlatego też podejmowane są działania w celu przekształcenia różnorodnych odpadów rolnych i leśnych na biopaliwa poprzez wykorzystanie cukrów budujących lignocelulozowe ściany komórkowe roślin.
Saccharomyces sp. Źródło węgla stanowi wtedy melasa, cukier, sok z trzciny cukrowej oraz z buraka cukrowego, skrobia kukurydziana lub ziemniaczana. Są to jednak surowce drogie, a ich dostępność zawsze zależy od sezonowej produktywności. Ponadto zastosowanie spożywczej kukurydzy czy ziemniaków w produkcji biopaliw jest kwestią kontrowersyjną. Dlatego też podejmowane są działania w celu przekształcenia różnorodnych odpadów rolnych i leśnych na biopaliwa poprzez wykorzystanie cukrów budujących lignocelulozowe ściany komórkowe roślin.
Według ustawy z dnia 14 grudnia 2012 roku o odpadach, produkty uboczne powstające podczas produkcji, mogą zostać wykorzystane bezpośrednio, bez dalszego przetwarzania. Z kolei odpady poddawane są odzyskowi lub zostają unieszkodliwione bądź zlikwidowane [Dz.U. 2013 poz. 21]. Właściwe zagospodarowanie biomasy odpadowej jest istotnym problemem, mającym związek z ochroną środowiska naturalnego. Wykorzystanie pozostałości poprodukcyjnych nie tylko minimalizuje negatywny wpływ odpadów na środowisko, ale również może korzystnie wpływać na finanse działalności gospodarczej (Urbaniec, 2004). Odpady organiczne z przemysłu rolno-spożywczego, w zależności od ich właściwości fizykochemicznych, mogą zostać wykorzystane m.in. do produkcji bioetanolu, który może być z kolei zastosowany w mieszankach paliwowych albo też znaleźć inne różnorodne wykorzystanie (Czyżyk i wsp., 2015).
Biomasa lignocelulozowa
Podstawowymi składnikami biomasy lignocelulozowej są: celuloza, hemiceluloza i lignina –polimery, które bardzo trudno podlegają degradacji do prostszych związków możliwych do wykorzystania przez drożdże. Stąd też zainteresowanie badaniami dotyczącymi metod chemicznej degradacji struktur lignocelulozowych, a w konsekwencji – maksymalizacji stopnia ich rozkładu do glukozy, ksylozy oraz związków fenolowych. Uzyskane związki węgla mogą być wówczas asymilowane przez drożdże, co wpływa na znaczne zwiększenie wydajności bioprocesów (Mosier i in., 2005; Wyman i in., 2005).
Najczęściej wykorzystywane do wstępnej obróbki biomasy są: hydroliza kwasowa (H2SO4), alkaliczna (NaOH), techniki zaawansowanego utleniania (H2O2), metody termiczne oraz enzymatyczne (celulazy, celobiozy, ksylanazy) (Kang i in., 2012; Michalska i in., 2011). Każda z tych metod prowadzi do uwalniania różnych produktów rozkładu. Zatem dobór odpowiedniej metody hydrolizy biomasy roślinnej ma kluczowy wpływ na efektywność całego procesu fermentacyjnego.
Saccharomyces cerevisiae czy drożdże niekonwencjonalne?
Wszystkie gatunki drożdży są zdolne do asymilacji glukozy, prawie wszystkie – fruktozy i mannozy, a wiele gatunków również galaktozy. Spośród disacharydów najczęściej wykorzystywana jest sacharoza. Jednak w produkcji etanolu II generacji klasyczne drożdże Saccharomyces sp. są mało przydatne, gdyż nie fermentują pentoz, wykazują niską tolerancję na alkohole, kwasy i rozpuszczalniki, natomiast charakteryzują się dużą wrażliwością na poziom pH oraz obecność związków cytotoksycznych: furfuralu, 5-hydroksymetylofurfuralu lub innych związków organicznych, wytwarzanych podczas hydrolizy. Ograniczenia S. cerevisiae bardzo utrudniają przebieg przemysłowych procesów fermentacyjnych. Uwaga mikrobiologów koncentruje się zatem na możliwości zastosowania innych drożdży, nie należących do rodzaju Saccharomyces, umownie nazywanych drożdżami niekonwencjonalnymi (ang. non-conventional yeasts). Są one zdolne m.in. do przyswajania nietypowych źródeł węgla, np. skrobi, celulozy, rafinozy, arabinozy, ksylozy, alkoholi cukrowych (ksylitol, sorbitol, mannitol, itp.) (Kręgiel i in., 2009). Wykorzystanie drożdży niekonwencjonalnych może zatem pozwolić na zagospodarowanie różnorodnej odpadowej biomasy roślinnej, produkcję etanolu oraz – co warto podkreślić – na otrzymanie pofermentacyjnej biomasy drożdży bogatej w białko i aminokwasy (Berlowska i in., 2015).
Drożdże niekonwencjonalne stanowią ogromną i nie do końca poznaną, różnorodną grupę jednokomórkowych mikroorganizmów eukariotycznych. Gatunki drożdży, inne niż Saccharomyces sp., oprócz wspomnianej wcześniej zdolności wykorzystania złożonych substratów, wykazują także inne cechy szczególnie istotne w warunkach przemysłowych – termo tolerancję oraz tolerancję na obecność inhibitorów wzrostu i fermentacji. Większość drożdży niekonwencjonalnych zostało wyizolowanych oraz scharakteryzowanych jako mikroflora zanieczyszczająca żywność i napoje (Martorell i in., 2007; Dujon, 2010). Szacuje się, że na przestrzeni tysiącleci drożdże niekonwencjonalne same wypracowały specyficzne mechanizmy, aby przetrwać w ekstremalnych warunkach środowiskowych. Ewolucja większości z tych gatunków była niezależna od S. cerevisiae (Souciet i in., 2009), a więc przypuszcza się, że większość gatunków „non-conventional yeasts” może wykazywać nowe, unikalne mechanizmy, których nie znajdzie się u klasycznych drożdży modelowych S. cerevisiae. Nowe techniki sekwencjonowania i zaawansowana inżynieria genetyczna dają możliwość poznania molekularnych podstaw ich wysokiej tolerancji na stres środowiskowy: zwiększone ciśnienie osmotyczne, wysokie stężenie etanolu, podwyższoną temperaturę fermentacji czy też obecność związków toksycznych. Należy także wspomnieć, że drożdże niekonwencjonalne wykazują wysokie tempo wzrostu w procesach fermentacyjnych, są zdolne do produkcji ważnych enzymów (np. inulinaza, p-galaktozydaza i pektynaza). Cechy te stanowią ogromny potencjał, który można wykorzystać do produkcji biopaliw z różnych surowców odpadowych.
Osmotolerancja
Komórki drożdży są narażone na stres osmotyczny podczas fermentacji przemysłowej. Zwłaszcza procesy prowadzone w podłożach o znacznej zawartości sacharydów – powyżej 300 g/L, wymagają zastosowania kultur drożdży osmotolerancyjnych (Watanabe i wsp., 2010; Tao i in., 2012.; Pais i in., 2013). W związku z tym rośnie zainteresowanie mikrobiologów i technologów zdolnością drożdży do wzrostu w środowiskach o wysokim stężeniu sacharydów lub soli. Molekularne mechanizmy odpowiedzialne za osmotolerancję u S. cerevisiae zostały dokładnie opisane w dostępnej literaturze (Erasmus, Vandermerwe i Vanvuuren, 2003; Wojda, 2003). Drożdże S. cerevisiae pozostają nadal organizmem modelowym do badania molekularnych podstaw tej ważnej cechy fizjologicznej, jednak naukowcy wyizolowali i zidentyfikowali niekonwencjonalne drożdże osmotolerancyjne należące do gatunku Zygosaccharomyces rouxii i Debaryomyces hansenii (Martorell i in., 2007; Leandro i wsp., 2011). Adaptacja drożdży do warunków stresu osmotycznego to złożony mechanizm, łączący w sobie sieć genów regulatorowych i szlaków sygnałowych, który różni się w zależności od gatunku i czynnika osmotycznego w otaczającym środowisku. Zachowanie komórek Z. rouxii przypomina aktywność S. cerevisiae w transporcie kationów Na+ z komórki lub wprowadzenia ich do wakuoli, natomiast halotolerancyjne drożdże D. hansenii gromadzą jony sodu wewnątrz komórek. Kolejna kwestia dotyczy reakcji, które zachodzą w komórkach drożdży pod wpływem różnych czynników osmotycznych. Cukry i poliole modyfikują ciśnienie osmotyczne, natomiast sole wywołują zarówno zmiany ciśnienia osmotycznego jak i homeostazy jonowej (Dakal i in., 2014).
Termotolerancja
Termotolerancja drożdży jest wysoce pożądaną cechą w procesach fermentacyjnych. Wydajny proces produkcji bioetanolu wymaga warunków dość wysokiej temperatury (~ 50oC) dla prowadzenia enzymatycznej hydrolizy biomasy przed jej fermentacją (Tabka i in., 2006). Co więcej, fermentacja prowadzona w wysokiej temperaturze obniża znacznie koszty chłodzenia, a także zmniejszenia ryzyka rozwoju zanieczyszczeń mikrobiologicznych(Anderson, Mcneil i Watson, 1986). Ograniczona tolerancja na temperaturę u drożdży S. cerevisiae (optymalny zakres 25-37◦C) zwiększa tym samym koszt wytwarzania etanolu (Nonklang i in., 2008; Abdel-Banat i in., 2010). Dlatego w celu osiągnięcia efektywnej fermentacji w warunkach wysokiej temperatury stosuje się mikroorganizmy termotolerancyjne, które mogą w takich warunkach nie tylko przeżywać, ale również efektywnie produkować etanol (Limtong, Sringiew i Yongmanitchai, 2007). Szczepy z gatunku Kluyveromyces marxianus zdolne są do fermentacji w temperaturze 45◦C (Kurylenko i in., 2014). Termotolerancja, szeroka aktywność enzymatyczna oraz zdolność fermentacji w warunkach wysokiego stężeniu sacharydów sprawia, że drożdże K. marxianus stanowią dobry materiał biologiczny do prowadzenia różnych procesów fermentacyjnych (Fonseca i in., 2008).
Tolerancja na etanol
Drożdże S. cerevisiae zostały opisane w literaturze jako najbardziej tolerancyjny na etanol gatunek drożdży. Regulacja metabolizmu u S. cerevisiae pozwala stłumić metabolizm oddechowy w warunkach beztlenowych lub w obecności wysokiego stężenia sacharydów, a tym samym stymulować tworzenie etanolu. Większość niekonwencjonalnych gatunków nie wykazuje takich uzdolnień regulacyjnych, co nie pozwala na efektywną produkcję etanolu w warunkach przemysłowych. Jednak kilka gatunków drożdży niekonwencjonalnych, np. Dekkera bruxellensis, Pichia kudriavzevii, Schizosaccharomyces pombe, Torulaspora delbrueckii czy Wickerhamomyces anomalus wykazuje dobre właściwości fermentacyjne i podobne poziomy tolerancji etanolu jak S. cerevisiae (Galafassi i in., 2011;. Zha i wsp., 2013; Mukherjee i wsp., 2014; Ruyters i in., 2015). Zwłaszcza D. bruxellensis jest w stanie zachować żywotność w środowisku zawierającym nawet 16% etanolu. Wykazano, że wydajność etanolu D. bruxellensis w hodowli okresowej w warunkach beztlenowych jest porównywalna z S. cerevisiae. D. bruxellensis wykazuje zdolność do „konkurencji” z klasycznymi drożdżami w warunkach przemysłowych, przypuszczalnie ze względu na przewagę nad S. cerevisiae w asymilacji azotanów (Radecka i in., 2015).
Tolerancja na furan i jego pochodne
Wykorzystanie hydrolizatów otrzymanych z biomasy do produkcji bioetanolu drugiej generacji jest bardzo złożona. W trakcie obróbki wstępnej uwalnianych jest wiele produktów ubocznych, toksycznych dla komórek drożdży (Taylor i wsp., 2012). Skład i stężenie tych związków hamujących jest bardzo zróżnicowane i zależne od rodzaju surowca lignocelulozowego oraz metody obróbki wstępnej (Zha, Muilwijk i Coulier, 2012). W czasie obróbki wstępnej i enzymatycznej hydrolizy frakcji hemicelulozy otrzymywane są zarówno heksozy: D-glukoza, D-galaktoza, D-mannoza i D-ramnoza, jak i pentozy: D-ksyloza i L-arabinoza (Palmqvist i Hahn-Hägerdal, 2000; Almeida, Modig i Petersson, 2007). Jednakże w warunkach wysokiej temperatury i ciśnienia, heksozy i pentozy są degradowane odpowiednio do hydroksymetylofurfuralu i furfuralu. Udowodniono szkodliwy wpływ tych związków, nawet przy niskich stężeniach, zwłaszcza na RNA, DNA, białka i membrany komórek drożdży (Janzowski i in., 2000; Lin, Qiao i wsp., 2009).
Usuwanie toksycznych związków ze środowiska fermentacyjnego jest zwykle bardzo kosztowne, zatem aby poprawić przebieg procesów fermentacyjnych zastosowanie furanotolerancyjnych szczepów drożdży jest bardziej praktyczne. Naukowcy poznali podstawy molekularne tolerancji na furan i jego pochodne u modelowych drożdży S. cerevisiae. Stwierdzono, że zwłaszcza zaburzenia w obrębie genu SIZ1, kodującego białka SUMO-ligazy E3, przynieść może znaczące zwiększenie tolerancji na furfural. Dobrą tolerancję na furfural wykazują niektóre niekonwencjonalne gatunki drożdży, a mianowicie W. anomalus, P. kudriavzevii, Candida stellata, C. ethanolica, P. fermentans i Z. balii. Oporność P. kudriavzevii na hydroksymetylofurfural osiąga poziom nawet 7 g/L.
Tolerancja na kwas octowy
Tolerancja na obecność słabych kwasów ma zasadnicze znaczenie w produkcji bioetanolu II generacji. Podczas wstępnej obróbki surowca lignocelulozowego, gdy uwalniane są grupy acetylowe hemicelulozy, tworzy się kwas octowy w stężeniu od 5 do 10 g/L (Martinez i wsp., 2001;. Qian i in., 2006; Villarreal i in., 2006; Chandel i in., 2007). Wiadomym jest, że słabe kwasy wykazują działanie cytotoksyczne na komórki drożdży. Na drodze dyfuzji biernej są one transportowane przez błonę komórkową do wnętrza komórek drożdży w postaci niezdysocjowanej, następnie ulegają dysocjacji, a protony akumulowane w cytoplazmie powodują zakwaszenie cytozolu (Mollapour i Piper, 2007). Wówczas metabolizm komórek wyraźnie zwalnia poprzez hamowanie enzymów glikolitycznych i dehydrogenazy NADH (Arneborg, Jespersen i Jakobsen, 2000; Brett i in., 2005; Pampulha Dias i Loureiro, 1990; Ding i wsp., 2009). Niski poziom wewnątrzkomórkowego pH hamuje wzrost drożdży, wydłuża fazę adaptacyjną oraz zmniejsza efektywność wytwarzania etanolu (Limtong i in., 2000; Cantarella i in., 2004). Dlatego też zastosowanie szczepów drożdży opornych na działanie słabych kwasów ma zasadnicze znaczenie dla przemysłowej produkcji bioetanolu. Należą do nich drożdże Z. bailli opisane w literaturze jako najbardziej oporne na kwas octowy. Mogą one rosnąć w stężeniu tak wysokim jak 24 g/L, podczas gdy S. cerevisiae wykazują porównywalny wzrost w stężeniu 9 g/L (Lindberg i wsp., 2013).
Biologiczna kontrola procesów fermentacyjnych
Szczególne zainteresowanie naukowców budzi możliwość wykorzystania zjawiska antagonistycznego oddziaływania drożdży i produktów ich metabolizmu wobec niepożądanych drobnoustrojów zanieczyszczających środowiska fermentacyjne. Obecność obcej mikroflory może spowodować znaczne obniżenie efektywności procesów biotechnologicznych. Drożdże niekonwencjonalne, charakteryzujące się aktywnością antagonistyczną wobec zróżnicowanej mikroflory, to m.in. przedstawiciele rodzajów: Pichia, Candida, Aureobasidium, Metschnikowia, Debaryomyces. Oddziaływania te szeroko zostały opisane w licznych pracach naukowych (Sharma i in., 2009, Liu i in., 2013, Kordowska-Wiater, 2011). Drożdże, ze względu na wysoki potencjał reprodukcyjny i bogaty aparat enzymatyczny, wykazują zdolność do szybkiego zasiedlania środowisk fermentacyjnych. Mikroorganizm-antagonista namnażając się, nie tylko zubaża pulę łatwo dostępnych składników pokarmowych dla innych mikroorganizmów, ale także zmniejsza ich potencjalną przestrzeń życiową.
Szczególnie przy małej dostępności składników pokarmowych w środowisku jednym z istotniejszych mechanizmów współzawodnictwa między szczepami drożdży jest aktywność killerowa. Zjawisko killerowe zaobserwowano po raz pierwszy u drożdży z gatunku S. cerevisiae w latach
60-tych ubiegłego wieku. Jednak do chwili obecnej cecha killerowa stwierdzona została również
u przedstawicieli niekonwencjonalnych rodzajów drożdży: Debaryomyces, Pichia, Kluyveromyces, Candida, Cryptococcus, Ustilago, Rhodotorula, Williopsis, Torulopsis, Zygosaccharomyces, Hansenula, Hanseniaspora i Metschnikowia. Białka toksyn killerowych charakteryzują się wysoko specyficznym spektrum działania uzależnionym od wartości pH, temperatury i warunków natlenienia środowiska. Poszczególne toksyny różnią się między sobą odpornością na działanie enzymów proteolitycznych, wrażliwością na substancje chemiczne, optymalnym pH działania, stabilnością temperaturową oraz są względem siebie antagonistyczne. W przypadku drożdży Metschnikovia pulcherrima maksymalny efekt killerowy występuje przy pH 3.6 – 5.2 po 48 – 72 godzinach inkubacji. Oddziaływanie drożdży killerowych na wrażliwe komórki drożdży obejmuje szybkie wiązanie heterodimerycznego białka killerowego z receptorami ściany komórkowej wrażliwych komórek. Następstwem związania się toksyny ze ścianą komórkową jest szereg fizjologicznych zmian, których końcowym efektem jest śmierć wrażliwej komórki. Początkowo ma miejsce załamanie gradientu protonowego i aminokwasowego, następuje wyciek jonów potasu, w kolejnym stadium dochodzi do uwolnienia ATP, zmniejszenia poziomu metabolitów oraz zniszczenia gradientu pH membrany komórkowej. Wszystkie wymienione procesy stopniowo prowadzą do śmierci wrażliwych komórek drożdży.
Stwierdzono, że szczepy Metschnikowia pulcherrima wykazują także wielki potencjał jako drożdże prowadzące naturalną kontrolę biologiczną przeciwko szerokiemu spektrum mikroorganizmów chorobotwórczych (Piano i in., 1997; Qin i in., 2004; Spadaro i in., 2002). M. pulcherrima wytwarza barwnik pulcheriminę, który gromadząc się w podłożu wzrostowym tworzy kompleks chelatowy z jonami żelaza (Kluyver i wsp., 1953). Wykazano, że przeciwbakteryjna i przeciwgrzybicza aktywność tych drożdży zależy od unieruchomienia żelaza przez pulcheriminę (Sipiczki, 2006). Zatem szczepy, które wytwarzają duże ilości pulcheriminy cieszą się wielkim zainteresowaniem technologów i mikrobiologów, jako drożdże hamujące wzrost chorobotwórczych bakterii, drożdży i pleśni. Substancja ta może stać się alternatywą dla antybiotyków i leków grzybobójczych, których ciągłe stosowanie prowadzi do wzrostu oporności wśród drobnoustrojów (Espinel-Ingroff, 2008; Steffens i in., 1996).
Podsumowanie
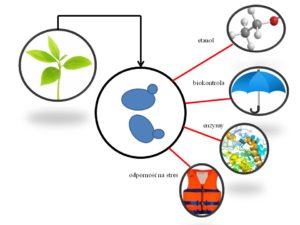
Drożdże S. cerevisiae to najbardziej znany gatunek stosowany w wielu procesach przemysłowych. Jednakże dla otrzymywania etanolu drugiej generacji, stosowanie tych drożdży napotyka na szereg trudności. Pomimo wysiłków podejmowanych w zakresie inżynierii S. cerevisiae w celu poprawy istotnych cech przemysłowych, zastosowanie drożdży klasycznych niestety nadal ma swoje ograniczenia. Badania wskazują, że istnieje możliwość, a nawet potrzeba zastosowania niekonwencjonalnych szczepów drożdży w celu zwiększenia wykorzystania możliwych źródeł węgla i poprawy efektów ekonomicznych procesu produkcji etanolu z surowców ligninocelulozowych. Mało znane niekonwencjonalne gatunki drożdży, o większej tolerancji na stresogenne warunki środowiska, mogą znaleźć zastosowanie jako monokultury lub kultury mieszane, zwiększając tym samym wydajność procesów otrzymywania etanolu II generacji. Warto zwrócić uwagę na jeszcze jeden aspekt – wiele gatunków drożdży niekonwencjonalnych produkuje unikalne związki aromatyczne, które mogą być postrzegane jako dodatkowy cenny produkt procesów fermentacyjnych. Przykłady korzystnych cech drożdży innych niż S. cerevisiae mogą służyć jako pierwszy krok dla prób zastosowania ich w różnych procesach przemysłowych. Era drożdży niekonwencjonalnych właśnie się rozpoczęła (rysunek).
Autorzy: Ewelina Pawlikowska, Magda Falih, Dorota Kręgiel,
Instytut Technologii Fermentacji i Mikrobiologii,
Wydział Biotechnologii i Nauk o Żywności,
Politechnika Łódzka
Literatura
-
Abdel-Banat B.M.A., Hoshida H., Ano A., Nonklang S., Akada R. (2010) High-temperature fermentation: How can processes for ethanol production at high temperatures become superior to the traditional process using mesophilic yeast?. App. Microbiol. Biot., 85, 861-867.
-
Almeida J.R.M., Modig T., Petersson A., Hähn-Hägerdal B., Lidén G., Gorwa-Grauslund M.F., (2007) Increased tolerance and conversion of onhibitors in lignocellulosic hydrolysates by Saccharomyces cerevsiae. J. Chem. Technol. Biot., 82, 340-349.
-
Anderson P.J., McNeil K., Watson K. High-efficiency carbohydrate fermentation to ethanol at temperatures above 40°C by Kluyveromyces marxianus marxianus isolated from sugar mills. Appl. Environ. Microb., 51, 1314-1320.
-
Arneborg N., Jespersen L., Jakobsen M. (2000) Individual cells of Saccharomyces cerevisiae and Zygosaccharomyces balill ehibit different short term intracellular oH responses to acetic acid. Arch. Microbiol., 174, 125-128.
-
Basso L.C., Basso T.O., Rocha S.N. (2011) Ethanol production in Brazil: The industrial process and its impact on yeast fermentation. W: Aurélio M., Bernardes S. (ed) Engineering . Energy Engineering. Biofuel Production-Recent Developments and Prospects. InTech, Rijeka, 85-100.
-
Berłowska J., Dudkiewicz M., Kręgiel D., Czyżowska A., Witońska I. (2015) Cell lysis induced by membrane-damaging detergent saponins from Quillaja saponaria. Enzyme Microb. Tech., 75-76, 44-48.
-
Boekhout T. (2005) Biodiversity – gut feeling for yeasts. Nature, 434, 449-451.
-
Bokulich N.A., Thorngate J.H., Richardson P.M., Mills D.A. (2014) Microbial biogeography of wine grapes is conditioned by cultivar, vintage, and climate. Proc. Natl. Acad. Sci. U S A, 111, 139-148.
-
Bostein D., Chervitz S.A., Cherry J.M. (1997) Yeast as a model organism. Science, 277, 1259-1260.
-
Brett C.L., Tukaye D.N., Mukherjee S., Rao R. (2005) The Yeast Endosomal Na+ (K+)/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking. Mol. Biol. Cell, 16, 1396-1405.
-
Cantarella M., Contarella L., Gallifuoco A., Spera A., Alfani F. (2004) Effect of inhibitors released during steam-explosion treatment of poplar wood on subsequent enzymatic hydrolysis and SSF. Biotechnol. Progr., 20, 200-206.
-
Chandel A.K., Kapoor R.K., Singh A., Kuhad R.C. (2007) Detoxification of sugarcane bagasse hydrolysate improves ethanol production by Candida shehatea NCIM 3501. Bioresource Technol., 98, 1947-1950.
-
Czyżyk F., Strzelczyk M. (2015) Racjonalne wykorzystanie pozostałości poprodukcyjnych sektora rolno-spożywczego. Archiwum Gospodarki Odpadami i Ochrony Środowiska, 17, 99-106.
-
Dakal T.C., Solieri L., Giudici P. (2014) Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii. Int. J. Food Microbiol., 185, 140-157.
-
Ding J., Huang X., Zhang L., Zhao N., Yang D., Zhang K. (2009) Tolerance and stress response to ethanol on the yeast Saccharomyces cerevisiae. Appl. Microbiol. Biot., 85, 253-263.
-
Dujon B. (2010) Yeast evolutionary genomics. Nat. Rev. Genet., 11, 512-524.
-
Erasmus D.J., Van Der Merwe G.K., Van Vuuren H.J.J. (2003) Genome-wide expression analyses: Metabolic adaptation of Saccharomyces cerevisiae to high sugar stress. FEMS Yeast Res., 3, 375-399.
-
Espinel-Ingroff A. (2008) Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Revista Iberoamericana de Micologia, 25, 101-106.
-
Fonseca G.G., Heinzle E., Wittmann C., Gombert A.K. (2008) The yeast Kluyveromyces marxianus and its biotechnological potential. Appl. Microbiol. Biotechnol., 79, 339-354.
-
Galafassi S., Merico A., Pizza F., Hellborg L., Molinari F., Piskur J., Compagno C. (2011) Dekkera/Brettanomyces yesta for ethanol production from renewable sources under oxygen-limited and low-pH conditions. J. Ind. Microbiol. Biot., 38, 1079-1088.
-
Génolevures Consortium (2009) Comparative genomics of protoploid Saccharomycetaceae. Genome Res., 19, 1696-1709.
-
Goffeau A., Barrell B.G., Bussey H. (1996) Life with 6000 genes. Science, 274, 546-567.
-
Janzowski C., Glaab V., Samimi E., Schlatter J., Eisenbrand G. (2000) 5-Hydroxymethylfurfural: assessment of mutagenicity, DNA-damaging potential and reactivity towards cellular glutathione. Food Chem. Toxicol., 38, 801-809.
-
Kang JH., Kim D., Lee TJ. (2012) Hydrogen production and microbial diversity in sewage sludge fermentation preceded by heat and alkaline treatment. Bioresource Technol., 109, 239-243.
-
Kluyveri A.J., Van der Walt J.P., Van Triet A.J. (1953) Pulcherrimin, the pigment of Candida Pulcherrima. Proc. Natl. Acad. Sci. USA, 39, 583-593.
-
Kordowska-Wiater M. (2011) Drożdże jako czynniki ochrony biologicznej roślin. Post. Mikrobiol., 50, 107-119.
-
Kregiel D., Kunicka-Styczyńska A., Czyżowska A. (2009) Drozdże. W: Libudzisz Z., Żakowska Z., Kowal K. (red) Mikrobiologia techniczna t. 2. PWN, Warszawa, 119-149.
-
Kurylenko O.O., Ruchala J., Hryniv O.B., Abbas C.A., Dmytruk K.V., Sibirny A.A. (2014) Metabolic engineering and classical selection of the methylotropic thermotolerant yeast Hansenula polymorpha for improvement of high-temperature xylose alcoholic fermentation. Microb. Cell Fact., 13, 122-132.
-
Leandro M.J., Sychrova H., Prista C., Loureiro-Dias M.C. (2011) The osmotolerant fructophilic yeast Zygosaccharomyces rouxii employs two plasma-membrane fructose uptake systems belonging to a new family of yeast sugar transporters. Microbiology, 157, 601-608.
-
Limtong S., Sringiwe C., Yangmanitchai W. (2007) Production of fuel ethanol at high temperature from sugar juice by a newly isolated Kluyveromyces marxianus. Bioresour. Technol., 98, 3367-3374.
-
Limtong S., Sumpradit T., Kitpreechavanich V., Tuntirungkij M., Seki T., Yoshida T. (2000) Effect of acetic acid on growth and ethanol fermentation of xylose fermenting yeast and Saccharomyces cerevisiae. Nat. Sci., 34, 64-73.
-
Lin F.M., Qiao B., Yuan Y.J. (2009) Comparative proteomic analysis of tolerance and adaptation of ethanologenic Saccharomyces cerevisiae to furfural, a lignocellulosic inhibitory compound. Appl. Environ. Microb., 75, 3765-3776.
-
Lindberg L., Santos A.X.S., Riezman H., Olsson L., Bettiga M. (2013) Lipidomic profiling of Saccharomyces cerevisiae and Zygosaccharomyces bailii reveals critical changes in lipid composition in response to acetic acid stress. PLoS ONE 8(9): e73936.
-
Liu J., Sui Y., Wisniewski M., Droby S., Liu Y. (2013) Review: Utilization of antagonistic yeasts to manage postharvest fungal diseases of fruit. Int. J. Food Microbiol., 167, 153-160.
-
Martinez A., Rodriguez M.E., Wells M.L., York S.W., Preston J.F., Ingram L.O. (2001) Detoxification of dilute acid hydrolysates of lignocellulose with lime. Biotechnol. Progr., 17, 287-293.
-
Martorell P., Stratford M., Steels H., Fernandez-Espinar M.T., Querol A. (2007) Physiological characterization of spoilage strains of Zygosaccharomyces bailii and Zygosaccharomyces rouxii isolated from high sugar environments. Int. J. Food Microbiol., 114, 234-242.
-
Michalska K., Miazek K., Krzystek L., Ledakowicz S. (2012) Influence of pretreatment with Fenton’s reagent on biogas production and methane yield from lignocellulosic biomass. Bioresour. Technol., 119, 72-78.
-
Mollapour M., Piper P.W. (2007) Hog1 Mitogen-activated protein kinase phosphorylation target the yeast Fps1 aquaglyceroporin for endocytosis, Thereby rendering cell resistant to acetic acid. Mol. Cell. Biol., 27, 6446-6456.
-
Mosier N., Wyman C., Dale B., Elander R., Lee Y.Y., Holtzapple M., Ladisch M. (2005) Features of promising technologies for pretreatment of lignocellulosic biomass. Bioresour. Technol. 96, 673-686.
-
Mukherjee V., Steensels J., Lievens B., Van de Voorde I., Verplaetse A., Aerts G., Willems K.A., Thevelein J.M., Verstrepen K.J., Ruyters S. (2014) Phenotypic evaluation of natural and industrial Saccharomyces yeasts for different traits desirable in industrial bioethanol production. Appl. Microbiol. Biotechnol., 98, 9483-9498.
-
Nonklang S., Abdel-Banat B.M.A., Cha-aim K., Moonjai N., Hoshida H., Limtong S., Yamada M., Akada R. (2008) High-temperature ethanol fermentation and transformation with linear DNA in the thermotolerant yeast Kluyveromyces marxianus DMKU3-1042. Appl. Environ. Microb., 74, 7514-7521.
-
Pais T.M., Foulquie-Moreno M.R., Hubmann G., Duitama J., Swinnen S., Goovaerts A., Yang Y., Dumortier F., Thevelein J.M. (2013) Comaparative polygenic analysis of maximal ethanol accumulation capacity and tolerance to high ethanol levels of cell proliferation in yeast. PLoS Genet., 9(6):e1003548.
-
Palmqvist E., Hahn-Hägerdal B. (2000) Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechanisms of inhibition. Bioresour. Technol., 74, 25-33.
-
Pampulha M.E., Loureiro-Dias M.C. (1990) Activity of glycolytic enzymes of Saccharomyces cerevisiae in the presence of acetic acid. Appl. Microbiol. Biotechnol., 34, 375-380.
-
Piano S., Neyrotti V., Migheli Q., Gullino M.L. (1997) Biocontrol capability of Metschnikowia pulcherrima against Botrytis postharvest rot of apple. Postharvest Biol. Tec., 11, 131-140.
-
Qian M., Tian S., Li X., Zhang J., Pan Y., Yang X. (2006) Ethanol production from dilute-acid softwood hydrolysate by co-culture. Appl. Biochem. Biotech., 134, 273-283.
-
Qin G., Tian S., Xu Y. (2004) Biocontrol of postharvest diseases on sweet cherries by four antagonistic yeasts in different storage conditions. Postharvest Biol. Tec., 31, 51-58.
-
Querol A., Fernandez-Espinar M.T., Del Olmo M., Barrio E. (2003) Adaptive evolution of wine yeast. Int. J. Food Microb., 86, 3-10.
-
Radecka D., Mukherjee V., Mateo R.Q., Stojiljkovic M., Foulquie-Moreno M.R., Thevelein M. (2015) Looking beyond Saccharomyces L The potential of non-conventional yeast species for desirable traits in bioethanol fermentation. FEMS Yeast Res., 15, art. nr fov053
-
Ruyters S., Mukherjee V., Verstrepen K.J., Thevelein J.M., Willems K.A., Lievens B. (2015) Assessing the potential of wild yeasts for bioethanol production. J. Ind. Microbiol. Biot., 42, 39-48.
-
Sharma R.R., Singh D., Singh R. (2009) Biological control of postharvest diseases of fruit and vegetables by microbial antagonists: A review. Biol. Control, 50, 205-221.
-
Sicard D., Legras J.L. (2011) Bread, beer and wine: yeast domestication in the Saccharomyces sensu stricto complex. C.R. Biol., 334, 229-236.
-
Sipiczki M. (2006) Metschnikowia strains isolated from botrytized grapes antagonize fungal and bacterial growth by iron depletion. Appl. Environ. Microbiol., 73, 6716-6724.
-
Spadaro D., Vola R., Piano S., Gullino M.L. (2002) Mechanism of action and efficacy of four isolates of the yeast Metschnikowia pulcherrima active against postharvest pathogens on apples. Postharvest Biol. Tec., 24, 123-134.
-
Steensels J., Verstrepen K.J. (2014) Taming wild yeast: potential of conventional and nonconventional yeasts in industrial fermentations. Annu. Rev. Microbiol., 68, 61-80.
-
Steffens J.J., Pell E.J., Tien M. (1996) Mechanisms of fungicide resistance in phytopathogenic fungi. Curr. Opin. Biotechnol., 7, 348-355.
-
Tabka M.G., Herpoel-Gimbert I., Monod F., Asther M., Sigoillot J.C. (2006) Enzymatic saccharification of wheat straw for bioethanol production by a combined cellulose xylanase and feruloyl esterase treatment. Enzyme Microb. Tech., 39, 897-902.
-
Tao X., Zheng D., Liu T., Wang P., Zhao W., Zhu M., Jiang X., Zhao Y., Wu X. (2012) A novel strategy to construct yeast Saccharomyces cerevisiae strains for very high gravity fermentation. PLoS ONE, 7(2): e31235.
-
Taylor M.P., Mulako I., Tuffin M., Cowan D. (2012) Understanding physiological responses to pre-treatment inhibitors in ethanologenic fermentations. Biotechnology Journal, 7, 1169-1181.
-
Urbaniec K. (2004) The evolution of evaporator stations in the beet-sugar industry. J. Food. Eng., 61, 505-508.
-
Villarreal M.L.M., Prata A.M.R., Felipe M.G.A., Almeida J.B., Silva E. (2006) Detoxification procedures of eucalyptus hemicellulose hydrolysate for xylitol production by Candida guilliermondii. Enzyme. Microb. Tech., 40, 17-24.
-
Watanabe J., Uehara K., Mogi Y., Suzuki K., Watanabe T., Yamazaki T. (2010) Improved transformation of the halo-tolerant yeast Zygosaccharomyces rouxii by electroporation. Biosci. Biotech. Bioch., 74, 1092-1094.
-
Wojda I., Alonso-Monge R., Bebelman J.-P., Mager W.H., Siderius M. (2003) Response to high osmotic conditions and elevated temperature in Saccharomyces cerevisiae is controlled by intracellular glycerol and involves coordinate activity of MAP kinase pathways. Microbiology, 149, 1193-1204.
-
Wyman C.E., Dale B.E., Elander R.T., Holtzapple M., Ladisch M.R., Lee Y.Y. (2005) Coordinated development of leading biomass pretreatment technologies. Bioresour. Technol., 96, 1959-1966.
-
Zha Y., Hossain A.H., Tobola F., Sedee N., Havekes M., Punt P.J. (2013) Pichia anomala 29X: A resistant strain for lignocellulosic biomass hydrolysate fermentation. FEMS Yeast Res., 3(7), 609-617.
-
Zha Y., Muilwij B., Coulier L., Punt P.J. (2012) Inhibitory compounds in lignocellulosic biomass hydrolysates during hydrolysate fermentation processes. J. Bioprocess Biotechniq., 2, 112.