Od początku lat 90-tych obserwowany jest w Polsce dynamiczny rozwój rynku smakowych wód mineralnych, napojów, nektarów i soków owocowych. Wzrasta bowiem świadomość polskiego konsumenta o wpływie codziennej diety na zdrowie i samopoczucie. Coraz większą popularnością cieszą się wody smakowe, nektary i soki, nierzadko wytwarzane na bazie nowych, egzotycznych owoców.
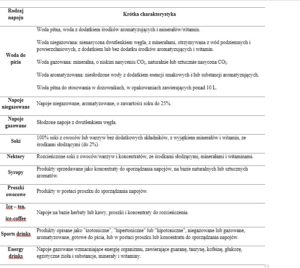
Współczesny rynek napojów bezalkoholowych jest bardzo zróżnicowany. Nowe produkty można podzielić, stosując różne kryteria, na przykład pod względem zawartości cukru i soków owocowych, zawartości aromatów, poziomu nasycenia dwutlenkiem węgla, oraz tzw. funkcjonalności. Oprócz wody pitnej, do najbardziej popularnych napojów w Polsce należą: (1) gotowe do spożycia napoje aromatyzowane; (2) gotowe do picia napoje zawierające owoce lub naturalne soki owocowe; (3) napoje sporządzone z koncentratów po ich rozcieńczeniu (Tabela 1).
Tabela 1. Rodzaje napojów bezalkoholowych [Kręgiel, 2015].
Szczególnie dynamicznie rozwija się w Polsce rynek napojów funkcjonalnych, obejmujących napoje wzbogacone sokami, witaminami i minerałami, napoje dla sportowców, napoje energetyzujące oraz typu wellness, poprawiające stan zdrowej równowagi umysłu, ciała i ducha człowieka. Wiele napojów funkcjonalnych zostało opracowanych w celu dokładnie zdefiniowanych korzyści zdrowotnych, np. poprawy pracy serca, zwiększenia odporności organizmu, poprawy trawienia czy też gospodarki energetycznej konsumenta. Odbiorcy poszczególnych napojów funkcjonalnych są bardzo zróżnicowani pod względem wieku i płci, z rosnącym naciskiem na dzieci, osoby uprawiające sport, kobiety oraz osoby starsze [Hoffmann and Jędrzejczyk, 2007].
Jednak istotnym problemem dla producentów tej branży jest pojawiający się brak stabilności mikrobiologicznej gotowych wyrobów, który objawia się niekorzystnymi zmianami organoleptycznymi i sensorycznymi. Zwłaszcza w miesiącach letnich, w wyższych niż umiarkowane temperaturach otoczenia, w produktach gotowych powstają wyraźne zmętnienia, pojawia się zmiana barwy lub wyczuwany jest odmienny, różny od typowego zapach i posmak [Kręgiel i Rygała, 2011]. Konsekwencją utrzymujących się problemów ze stabilnością napojów może być pogorszenie brandingu, czyli wizerunku marki, oraz istotne straty ekonomiczne dla producenta.
Skład mikroflory zanieczyszczającej produkt, odpowiedzialnej za niekorzystne zmiany w produkcie, jest zwykle bardzo zróżnicowany i zależny od jakości wszystkich surowców wchodzących w skład napoju: wody, cukru lub innych substancji słodzących, soków i aromatów oraz pozostałych komponentów stosowanych do ich produkcji. Napoje bezalkoholowe są wyrobami o wysokiej aktywności wody, bogatymi w sacharydy, witaminy i minerały, dlatego reprezentują bardzo dobre środowisko dla wzrostu różnych rodzajów mikroorganizmów, ale największe szanse na wzrost ma stosunkowo wąska grupa drobnoustrojów acidofilnych [Satora i Tuszyński, 2003].
Wody pitne
Naturalne wody mineralne i źródlane, stosowane do produkcji napojów, nektarów i soków, zanieczyszczone są zwykle niewielką liczbą drobnoustrojów. Dominującą mikroflorą takich wód to głównie gramujemne bakterie należące np. do rodzajów Pseudomonas, Aeromonas, Mycobacterium, Xanthomonas, o niewielkich wymaganiach pokarmowych [Kręgiel i Rygała, 2011]. Uważane są one za bakterie saprofityczne lub warunkowo patogenne, zaś minimalna dawka infekcyjna MID (ang. minimal infection dose) jest duża i wynosi od 104 do 109 komórek. Jednakże warto podkreślić, że w obecności nawet niewielkiego stężenia biodegradowalnych rozpuszczalnych związków węgla – tzw. BDOC (ang. Biodegradable Dissolved Organic Carbon) następuje znaczący wzrost tych bakterii. Dodatkowo, fotodegradacja rozpuszczonej materii organicznej poprzez ekspozycję wód na działanie światła słonecznego może korzystnie wpływać na rozwój drobnoustrojów wykorzystujących takie produkty rozkładu [Satora i Tuszyński, 2003].
Poszczególne szczepy, między innymi wyżej wymienionych gatunków bakterii, są wykrywane w ogólnej ocenie mikrobiologicznej wody. Mikroorganizmy te mogą powodować zakażenia u osób wrażliwych, z obniżoną odpornością (niemowlęta i małe dzieci, osoby starsze i przewlekle chore). Liczba takich osób systematycznie wzrasta, a więc warto pamiętać, że termin „woda pitna” nie zawsze jest odpowiedni dla wszystkich potencjalnych konsumentów.
W zanieczyszczonych próbach wody pitnej, z widocznymi objawami wzrostu w postaci zmętnień i wykłaczeń, obserwuje się często wzrost grzybów strzępkowych należących do rodzajów Penicillium, Cladosporium, Acremonium i Alternaria [Cabral i Pinto, 2002]. Wody mineralne i źródlane, zwłaszcza przechowywane w różnego rodzaju zbiornikach i dyspenserach, często zanieczyszczone są drożdżami z rodzaju Candida: C. parapsilosis i C. glabrata [Yamaguchi i in., 2007]. Obecność tych grzybów w wodzie pitnej może powodować bóle brzucha, zaparcia i biegunki, alergie pokarmowe, czy suchość w gardle, a nawet prowadzić do ciężkich infekcji. Szczególnie narażoną grupą konsumentów są osoby z upośledzoną odpornością organizmu (HIV/AIDS), po chemioterapii, leczeniu immunosupresyjnym lub chorzy na mukowiscydozę lub cukrzycę.
Drobnoustroje występujące w wodzie, zwłaszcza bakterie gramujemne, wykazują silne zdolności adhezyjne i tworzą biofilmy na powierzchniach stalowych i z tworzyw sztucznych. Utworzona błona biologiczna jest środowiskiem przyjaznym dla rozwoju innych rodzajów drobnoustrojów, w tym typowej mikroflory napojów czy soków. Warto podkreślić, że zanieczyszczenia produktów mikroorganizmami pochodzącymi z powstałych biofilmów nie muszą mieć stałego charakteru. Ze względu na cykl namnażania drobnoustrojów na powierzchniach materiałów i powstawanie błony biologicznej, mikroorganizmy wchodzące w jej skład mogą budować biofilm, nie wykazując wybitnych właściwości adhezyjnych. Drobnoustroje uwalniane są z ukształtowanego biofilmu okresowo, jako pojedyncze komórki, a niekiedy nawet w postaci większych skupisk osobników. Jest to o tyle istotne, że w wielu przypadkach część produktów jednej partii może wykazywać objawy zanieczyszczenia, podczas gdy inna część obejmować produkty czyste mikrobiologicznie. Utworzony biofilm na wewnętrznych powierzchniach instalacji jest trudny do usunięcia przy zastosowaniu standardowych metod mycia i dezynfekcji, zwłaszcza w instalacjach przepływowych[Kręgiel i Rygała, 2010].
Cukier i syropy
Do produkcji napojów zwykle stosuje się naturalne syropy roślinne, syropy cukrowe otrzymane poprzez rozpuszczenie cukru rafinowanego w wodzie lub wyprodukowane w wyniku enzymatycznej lub chemicznej hydrolizy skrobi. Powszechnie stosuje się sacharozę, glukozę lub fruktozę w postaci granulatów, proszków lub syropów, w skład których wchodzi jeden cukier lub ich mieszanina. Dodatkowo, w produktach stosowane są inne substancje słodzące, zarówno syntetyczne jak i pochodzenia naturalnego. Specjalnymi środkami słodzącymi, dopuszczonymi do zastosowania jako dodatki do żywności są: aspartam, Acesulfam K, sukraloza i sacharyna, a także: stewia, ksylitol, trehaloza, izomaltuloza, czy erytriol [Ashurst i Hargitt, 2009].
Główną mikroflorę cukru i syropów cukrowych stanowią bakterie mezofilne i/lub termofilne. Wśród mezofili na szczególną uwagę zasługują bakterie kwasu mlekowego z rodzaju Leuconostoc oraz bakterie przetrwalnikujące z rodzaju Bacillus i Paenibacillus. Gatunkiem termofilnym często izolowanym z próbek cukru jest Geobacillus stearothermophilus. Wśród mikroflory zanieczyszczającej cukier i syropy cukrowe oznaczane są bardzo często drożdże osmofilne np. Zygosaccharomyces rouxii oraz zarodniki grzybów strzępkowych z rodzajów: Aspergillus, Penicillium, Rhizopus i Cladosporium [Stratford, 2006].
Głównym parametrem związanym ze specyficznym środowiskiem cukru i syropów cukrowych jest niska aktywność wody (Aw). Większość mikroorganizmów wykazuje wzrost w środowiskach, których Aw wynosi od 0.91 do 0.99. Poniżej tych wartości ich wzrost może być zahamowany. Niska wartość tego parametru w środowisku hamuje wzrost większości drobnoustrojów chorobotwórczych. Jednak psucie syropów i cukrów może wystąpić w wyniku wzrostu osmofilnych drożdży i kserofilnych pleśni, których wzrost obserwowany jest w środowiskach o Aw 0,75-0,60. Zatem nie dziwi fakt, że produkty zawierające wysokie stężenia cukru, stanowią częste środowisko rozwoju drobnoustrojów. Należy również pamiętać, że pomimo tego, że surowce bezwodne lub nisko uwodnione oznaczone są jako stabilne mikrobiologicznie, nie oznacza to, że nie zawierają one mikroorganizmów zanieczyszczających. W wyniku rozcieńczenia surowca w procesie produkcji, następuje wzrost aktywności wody w środowisku, co zmienia stan anabiozy (uśpienia) u drobnoustrojów na warunki dogodne dla ich wzrostu.
Soki i aromaty owocowe
Mikroflora soków lub aromatów zależy od rodzaju owoców, ich pochodzenia oraz sposobu konserwacji. Większość mikroorganizmów, które są wykrywane na powierzchni owoców i warzyw, to mikroflora gleby, bardzo zróżnicowana społeczność drobnoustrojów. Cząstki gleby, powietrze oraz woda stanowią swoiste wektory przenoszące mikroflorę na powierzchnię owoców. Tkanki wewnętrzne bogate są w składniki odżywcze, ale przed szybką inwazją chroni owoc jego skórka. Jej struktura składa się głównie z celulozy, hemicelulozy, polisacharydów i pektyn. Również zróżnicowana społeczność epifitycznych mikroorganizmów kolonizująca zewnętrzną powierzchnię owoców stanowi dodatkową barierę konkurencyjną dla mikroorganizmów zanieczyszczających. Jednak mikroflora powodująca psucie dokonuje stopniowej inwazji rozkładając polimery powierzchni owoców i warzyw, wykorzystując swoje zewnątrzkomórkowe enzymy lityczne, aby następnie dotrzeć do wnętrza surowców, które stanowi źródło łatwo przyswajalnych cukrów: głównie fruktozy i glukozy. Szczególnie ważną grupą drobnoustrojów są grzyby, charakteryzujące się zdolnością syntezy różnych zewnątrzkomórkowych pektynaz i hemicelulaz, uważanych za istotny czynnik tego rodzaju psucia (psucia grzybiczego) [Kręgiel i in., 2008].
Główne zanieczyszczenie owoców, około 50-75% całej populacji, stanowią drożdże z rodzajów Kloeckera i Hanseniaspora. Dokonana charakterystyka jakościowa wyizolowanych szczepów z owoców lokalnych, wykazała stosunkowo wysoki udział (30%) drożdży należących do rodzaju Debaryomyces oraz Rhodotorula. Wśród pleśni najliczniej reprezentowane są rodzaje Alternaria, Aureobasidium i Cladosporium, Rhizopus, obejmując od 87% wszystkich grzybów strzępkowych [Tuszyński i Satora, 2003]. Bakterie w tego typu środowiskach reprezentowane są przez rodzaje: Pseudomonas, Erwinia, Xanthomonas, Acidovorax. Do bakterii zanieczyszczających środowiska owoców należy wymienić także bakterie kwasu mlekowego (Leuconostoc sp.) i bakterie kwasu octowego (Acetobacter sp., Gluconobacter sp.) [Solieri i Giudici, 2009].
Należy jednak pamiętać, że w przyrodzie niezmiernie często spotykane są współzależności drobnoustrojów, polegające między innymi na wzajemnym udostępnianiu składników odżywczych. Przykładowo, powszechnym zakażeniem owoców winogrona są pleśnie należące do rodzaju Botrytis [Solieri i Giudici, 2009]. Grzyby te, niszcząc skórki owoców, ułatwiają dostęp do cukrów prostych innym grupom drobnoustrojów, np. drożdżom lub bakteriom kwasu octowego z rodzajów Acetobacter, Gluconobacter i Gluconacetobacter. Drobnoustroje te stanowią główne zanieczyszczenie w przemyśle winiarskim, ale także spotykane są również jako mikroflora psująca napoje bezalkoholowe [Moore i in. 2002].
Marchew i buraki, należące do warzyw okopowych, są najczęściej stosowane do produkcji soków warzywnych, owocowo-warzywnych oraz napojów. Ze względu na kontakt z glebą, na powierzchni korzeni może występować liczna i złożona mikroflora, nawet w ilości kilkunastu milionów komórek w 1 gramie tych produktów. Dominują tu laseczki z rodzajów Clostridium i Bacillus, promieniowce, równie często spotykane są drożdże i pleśnie. Przy intensywnym nawożeniu naturalnym mogą występować również saprofityczne bakterie pochodzenia jelitowego oraz mikroflora chorobotwórcza, np. bakterie z rodzajów Listeria, Yersinia, Aeromonas oraz Escherichia [Kręgiel i in., 2008].
Rozwój znacznej części mikroflory bakteryjnej w wodach smakowych i napojach owocowych jest naturalnie ograniczony przez niskie pH, istnieje jednak duże niebezpieczeństwo namnażania się drobnoustrojów acydofilnych, np. bakterii fermentacji octowej i mlekowej, których wzrost obserwowany jest w środowiskach o pH 3. Również niebezpieczne jako zanieczyszczenie napojów pasteryzowanych są acydotermofilne, przetrwalnikujące bakterie z rodzaju Alicyclobacillus [Sokołowska, 2014]. W następstwie rozwoju tych bakterii w produktach wytwarzanych na bazie owoców tropikalnych może pojawić się m.in. fenolowy, ‘apteczny’ zapach, związany z tworzeniem gwajakolu i 2,6-dibromofenolu [Teixeira i Bongs, 2009]. Zmiany organoleptyczne smakowych wód mineralnych wywoływane są często przez bakterie fermentacji octowej należące do rodzajów Gluconobacter i Asaia [Moore i in. 2002a; Kregiel i in, 2012]. Oprócz bakterii octowych, za śluzowacenie napojów, odpowiedzialne mogą być także bakterie mlekowe z rodzaju Leuconostoc. Wśród pleśni często występują rodzaje Alternaria, Aureobasidium, Acremonium i Cladosporium.
Tabela 2. Typowe mikroorganizmy zanieczyszczające napoje bezalkoholowe [Kręgiel, 2015]
Składniki dodatkowe
Dodatkami mającymi na celu zapewnienie stabilności mikrobiologicznej produktów, a tym samym przedłużenie okresu przydatności do spożycia, są chemiczne konserwanty. W tym celu, w produkcji napojów bezalkoholowych stosowane są: sorbiniany, benzoesany oraz dwuwęglan dimetylu (DMDC) [Antolak i Kręgiel, 2017].
Konserwanty i regulatory kwasowości wprowadzone do napojów stymulują proces anabiozy mikroflory zanieczyszczającej. Dodatki te mogą jednak, w określonych warunkach pH i temperatury, ulegać rozkładowi, a produkty reakcji stają się wówczas źródłem pierwiastków biogennych, niezbędnych do wzrostu drobnoustrojów zanieczyszczających. Kwas cytrynowy, powszechnie stosowany regulator kwasowości i konserwant, to słaby kwas organiczny. Niektóre mikroorganizmy, np. bakterie mlekowe z rodzajów Leuconostoc, octowe z rodzaju Asaia, bakterie z grupy coli, np. Enterobacter, a także drożdże z rodzaju Candida i pleśnie są zdolne do wykorzystywania tego związku jako źródła węgla. Zmniejszenie zawartości kwasu cytrynowego w produkcie końcowym, a tym samym wzrost poziomu pH, może być więc wynikiem asymilacji tego kwasu przez mikroflorę zanieczyszczającą.
Wykorzystanie surowców jak źródła azotu czy węgla dotyczyć może także sztucznych środków słodzących, np. aspartamu. Słodzik ten należy do grupy estrów peptydowych, a w jego skład wchodzą m.in. dwa aminokwasy: kwas asparaginowy oraz fenyloalanina. W warunkach podwyższonej temperatury oraz wzrostu poziomu pH powyżej 7, związek ten może ulegać stopniowej hydrolizie do metanolu oraz wolnych aminokwasów. Związki te są następnie wykorzystywane jako źródło węgla i azotu przez mikroflorę zanieczyszczającą wody smakowe.
Niektóre drobnoustroje nie tylko nie wykazują wrażliwości na stosowane środki konserwujące, ale są zdolne nawet do ich wykorzystania. Szczególnie oporne na konserwanty są drożdże Zygosaccharomyces sp. oraz bakterie Alicyclobacillus acidocaldarius i Propionibacterium cyclohexanicum, których wzrost obserwowany może być nawet w produktach zawierających maksymalne dawki konserwantów.
Kwas benzoesowy może stanowić łatwo przyswajalne źródło węgla dla bakterii należących do rodzajów: Pseudomonas, Vibrio czy Nocardia, a także niektórych rodzajów grzybów strzępkowych, np. Rhizopus sp. i Mucor sp. W zależności od rodzaju drobnoustrojów degradujących ten związek, zazwyczaj powstaje dwutlenek węgla i/lub alkohol benzylowy, zmieniający walory sensoryczne produktom, nadając im charakterystyczny jaśminowy zapach.
Napoje funkcjonalne bardzo często wzbogacane są o witaminy i minerały. Jednak warto pamiętać, że substancje te stanowią grupę związków będących kofaktorami białek niezbędnych do prawidłowego funkcjonowania bakterii, drożdży i pleśni. Co więcej, mogą one również zwiększać przeżywalność komórek mikroorganizmów. Powszechnie stosowane witaminy z grupy B, znacząco stymulują wzrost bakterii z rodzaju Lactobacillus oraz drożdży Zygosaccharomyces sp. [Ewe i in., 2010]. Z kolei tauryna, zawarta w napojach energetycznych, stanowić może źródło azotu dla patogennych bakterii Klebsiella sp. [Chien, 2008]. Co więcej, związki fenolowe, które są stosowane w napojach w celu zwiększenia efektu pobudzenia, wykorzystywane mogą być przez drożdże Saccharomyces cerevisiae lub bakterie mlekowe Lactobacillus plantarum, które w efekcie wytwarzać mogą niepożądane związki zapachowe odpowiedzialne za zmianę cech sensorycznych produktów.
Opakowania
Harmonizacja przepisów dotyczących materiałów do kontaktu z żywnością jest dynamiczna, co oznacza, że dla określonych materiałów dopuszczonych do kontaktu z żywnością istnieją konkretne wymagania, które są jednak w procesie ciągłej ewolucji. Obecnie prawodawstwo UE obejmuje następujące materiały: folie celulozowe, ceramikę, tworzywa sztuczne, elastomery i gumy, powłoki i kleje. Wymagania ogólne dotyczące wszystkich materiałów mających kontakt z żywnością, są określone w rozporządzeniu ramowym WE 1935/2004. Każda migracja niebezpiecznych poziomów substancji chemicznych z materiału do żywności, zmieniających skład produktu lub mających negatywny wpływ na jego smak i/lub zapach, jest niedopuszczalna. Dobra praktyka wytwarzania materiałów i wyrobów przeznaczonych do kontaktu z żywnością jest opisana w rozporządzeniu WE 2023/2006. Istnieją także regulacje UE dla poszczególnych materiałów: ceramiki, folii z regenerowanej celulozy, tworzyw sztucznych, recyklingu tworzyw sztucznych oraz aktywnych i inteligentnych opakowań [Kręgiel, 2015].
Opakowania ze szkła wydają się być rozwiązaniem najbezpieczniejszym dla pakowania i przechowywania żywności, gdyż nie ma tu zjawiska migracji substancji chemicznych. Recykling szkła jest również bardziej przyjazny dla środowiska niż recykling tworzyw sztucznych, które mogą emitować związki toksyczne. Jednakże wykazano, że w pewnych warunkach szklane butelki mogą zanieczyścić wodę mineralną związkami ołowiu i cyrkonu. Inne pierwiastki mogą być dodawane do szkła podczas procesu produkcji, aby podkreślić kolor szkła, np. Fe i Cr – kolor zielony lub Co – niebieski. Z kolei z opakowań wykonanych politereftalanu etylenu (PET) uwalnia się głównie aldehyd octowy i Sb. I tym razem, podobnie jak w przypadku dodatków do napojów, kluczowym parametrem, od którego zależy uwalnianie niepożądanych związków do napojów jest pH wyrobu oraz temperatura przechowywania [Shotyk i in., 2006]. Wykazano, że proces ługowania pierwiastków z materiałów opakowaniowych znacznie wzrasta w kwaśnych środowiskach, których pH oscyluje w granicach 3,5. Istotnym czynnikiem wpływającym na uwalnianie pierwiastków i związków chemicznych jest dostęp i czas ekspozycji na światło słoneczne. Czynnik ten szczególnie wpływa na uwalnianie bisfenolu A (BPA), wykorzystywanego do produkcji poliestrów, polieterów, żywic epoksydowych, tworzyw sztucznych, a co za tym idzie przezroczystych plastików. Związek ten wykazuje negatywne działanie na metabolizm, a zwłaszcza na system hormonalny [Peretz i in., 2014].
Grupą związków stosowanych w produkcji materiałów opakowaniowych w celu ich zmiękczenia, a tym samym zwiększenia elastyczności są ftalany, czyli estry kwasu ftalowego. Podobnie jak wyżej wymienione związki, ftalany również ulegają ługowaniu do napojów [Kręgiel, 2015]. Podobnie jak w przypadku BPA, ftalany charakteryzują się negatywnym działaniem na układ hormonalny, wykazując słabe działanie estrogenne. Ich obecność w żywności może prowadzić, w szczególności u kobiet w ciąży i dzieci, do upośledzenia układu hormonalnego i płciowego noworodków [Keresztes i in., 2013]. Co więcej, związki te łatwo migrują do układu pokarmowego, a co za tym idzie do krwi a wraz z nią innych narządów wewnętrznych, między innymi nerek, wątroby i płuc.
Oprócz bezpośredniego wpływu na skład chemiczny produktów, materiały opakowaniowe mogą przyczyniać się do wzrostu i adhezji drobnoustrojów na ściankach opakowania. W odróżnieniu od szklanych butelek, opakowania wykonane z materiałów plastikowych charakteryzują się większą hydrofobowością oraz większym ładunkiem elektrostatycznym. Parametry te odpowiedzialne są między innymi za zwiększoną absorbcję substancji oraz drobnoustrojów na wewnętrznych ściankach opakowań. Dodatkowo, zjawisko to jest podstawą do adhezji drobnoustrojów, co w konsekwencji prowadzi do tworzenia biofilmów [Kręgiel, 2015]. Wykazano, że materiały takie jak PET, polistyren czy polipropylen stanowią powierzchnie sprzyjające adhezji bakterii w porównaniu do materiału szklanego [Antolak i in., 2017]. Co więcej, niezmiernie istotnym z punktu widzenia bezpieczeństwa mikrobiologicznego żywności jest fakt, że plastiki wykazują również przepuszczalność dla gazów, która umożliwia wzrost mikroorganizmom tlenowym. To złożone zjawisko w literaturze opisane jest jako „efekt butelkowania” i łączy w sobie zależności pomiędzy materiałem opakowaniowym, objętością opakowania oraz wzrostem drobnoustrojów. Przeprowadzone badania świadczą że mniejsze objętości butelek sprzyjają wzrostowi bakterii zanieczyszczających napoje bezalkoholowe [Hammes i in. 2010; Kręgiel i Antolak, 2016].
Warto zapamiętać
Ze względu na różnorodną mikroflorę, którą mogą ze sobą wnosić surowce stosowane do produkcji smakowych wód mineralnych, zanieczyszczenie produktu finalnego jest wynikiem wzajemnych interakcji pomiędzy mikroorganizmami, składem napoju oraz opakowaniem. Wzajemne zależności i warunkowania są często bardzo złożone, a niskie pH oraz obecność konserwantów często nie zapewnia stabilności mikrobiologicznej napojów.
Jakość i bezpieczeństwo zdrowotne produktów powinny być zagwarantowane przez odpowiednią jakość surowców i opakowań, utrzymanie właściwej higieny linii technologicznej, zapobieganie tworzeniu biofilmów oraz dobór odpowiednich metod monitoringu.
Autorzy: dr hab. inż. Dorota Kręgiel, mgr inż. Hubert Antolak
Instytut Technologii Fermentacji i Mikrobiologii
Politechnika Łódzka
Literatura:
- Antolak H., Kręgiel D. 2017. Skład napojów funkcjonalnych a ich stabilność mikrobiologiczna. Przemysł Spożywczy, 1, 15-18.
- Antolak H., Kręgiel D., Czyżowska A. 2017. Antibacterial and antiadhesive activities of extracts from edible plants against soft drink spoilage by Asaia Journal of Food Protection, 1, 25-34.
- Ashurst P.R., Hargitt R. 2009. Soft drink and fruit juice problems solved. Woodhead Publishing.
- Cabral D., Pinto VEF. 2002. Fungal spoilage of bottled mineral water. International Journal of Food Microbiology, 72, 73-76.
- Chien C.-C. 2008. Taurine serves as sole source of nitrogen for aerobic and anaerobic growth by Klebsiella World Journal of Microbioly and Biotechnology, 24, 895-898.
- Ewe J.A., Wan-Abdullah W.-N., Liong M.-T. 2010. Viability and growth charasteristics of Lactobacillus in soymilk supplemented with B-vitamins. International Journal of Food Science and Nutrition, 61, 87-107.
- Hammes F., Vital M., Egli T. 2010. Critical evaluation of the volumetric „bottle effect” on microbial batch growth. Applied and Environmental Microbiology, 76, 1278-1281.
- Hoffmann M., Jędrzejczyk H. 2007. Napoje funkcjonalne nowej generacji. Agro Przemysł, 3, 51-52.
- Keresztes S., Tatár E., Czégény Z., Záray G., Mihucz VG. 2013. Study on the leaching of phthalates from polyethylene terephthalate bottles into mineral water. Science of the Total Environment, 458-460, 451-458.
- Kręgiel D. 2015. Health Safety of Soft Drinks: Contents, Containers, and Microorganisms. BioMed Research International. DOI: 10.1155/2015/128697.
- Kręgiel D., Antolak H. 2016. Growth of Asaia in flavored mineral water – evaluation of the volumetric “Bottle Effect”. International Journal of Food Processing Technology, 3, 62-65.
- Kręgiel D., Piątkiewicz A., Żakowska Z., Kunicka-Styczyńska A. 2008. Zanieczyszczenia mikrobiologiczne surowców. W: Libudzisz Z., Kowal K., Żakowska Z. Mikrobiologia techniczna t.2 PWN, Warszawa.
- Kręgiel D., Rygala A. 2011. Jakość wód mineralnych i napojów – problemy mikrobiologiczne. Przemysł spożywczy, 6, 27-29.
- Kręgiel D., Rygała A., Libudzisz Z., Walczak P., Oltuszak-Walczak E. 2012. Asaia lannaensis the spoilage acetic acid bacteria isolated from strawberry-flavored bottled water in Poland. Food Control, 1, 147-150.
- Moore J.E., McCalmont M., Xu J., Millar B.Ch., Heaney N. 2002a. Asaia, an unusual spoilage organism of fruit-flavored bottled water. Applied and Environmental Microbiology, 68, 4130-4131.
- Moore JE, Xu J, Heaney N, Millar BC. 2002b. Spoilage of fruit-flavoured bottled water by Gluconobacter sacchari. Food Microbiology, 19, 399-401.
- Peretz J., Vrooman L., Ricke WA., Hunt PA., Ehrlich A., Hauser R. Padmanabhan V., Taylor HS., Swan SH., VandeVoort CA., Flaw JA. 2014. Bisphenol A and Reproductive Health: Update of Experimental and Human Evidence, 2007-2013. Environmental Health Perspectives, 122. DOI: 10.1289/ehp.1307728.
- Satora P., Tuszyński T. 2003. Problemy mikrobiologiczne w wodach mineralnych naturalnych i smakowych. Laboratorium, 6, 34-39.
- Shotyk W., Krachler M. Chen B. 2006. Contamination of Canadian and European bottled waters with antimony from PET containers. Journal of Environmental Monitoring, 2, 288-292.
- Sokołowska B. 2014. Alicyclobacillus – termofilne kwasolubne bakterie przetrwalnikujące – charakterystyka i występowanie. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 4, 5-17.
- Solieri L., Giudici P. 2009. Vinegars of the world. Springer Milan.
- Stratford M. 2006. W: Querol H., Fleet G. (Ed.) Yeasts in food and beverages, Berlin, Germany: Springer-Verlag, 335-379.
- Teixeira N., Bongs G. 2009. Observing the growth habits of species in non-alcoholic beverages. Brauwelt International, 4, 198-203.
- Tuszyński T., Satora P. 2003. Microbiological characteristics of the Węgierka Zwykła plum orchard in submontane region. Polish Journal of Food and Nutrition Sciences, 12/53 (2), 43-48.
- Yamaguchi MU., Rampazzo RCP., Yamada-Ogatta SF., Nakamura CV., Ueda-Nakamura T., Filho BPD. 2007. Yeasts and filamentous fungi in bottled mineral water and tap water from municipal supplies. Brazilian Archives of Biology and Technology, 50, 1-9.